1.簡介
2019年12月,中國武漢發生了一系列急性非典型呼吸系統疾病。這從武漢迅速傳播到其他地區。很快就發現了一種新型冠狀病毒。新型冠狀病毒與SARS-CoV具有高度同源性(〜80%),因此被稱為嚴重急性呼吸道綜合症冠狀病毒2(SARS-CoV-2,2019-nCoV),這導致了急性呼吸窘迫綜合徵(ARDS)和在2002-2003年期間死亡率很高。
據認為,SARS-CoV-2的爆發最初是通過與中國武漢市海鮮市場有關的人畜共患病傳播而開始的。後來人們認識到,人與人之間的傳播在隨後的爆發中發揮了重要作用。由這種病毒引起的疾病稱為冠狀病毒疾病19(COVID-19),世界衛生組織(WHO)宣布大流行發生。COVID-19已經影響了一大批人世界範圍內,被報導在大約200個國家和地區。隨著2020年4月7日的,在全球共有1400000案例已根據約翰霍普金斯大學中心系統科學與工程(CSSE)報導出來。
SARS-CoV-2病毒主要影響呼吸系統,儘管也涉及其他器官系統。來自中國武漢的首例病例報告了下呼吸道感染相關的症狀,包括發燒,乾咳和呼吸困難。此外,還觀察到頭痛,頭暈,全身無力,嘔吐和腹瀉。現已廣泛認識到,COVID-19的呼吸道症狀極不均勻,從極少的症狀到ARDS的嚴重缺氧不等。在上述武漢的報告中,從症狀發作到ARDS發生的時間短至9天,這表明呼吸道症狀可以迅速進展。這種疾病也可能致命。
流行病學研究已經表明,死亡率主要是在老年人群而發病率在兒童低得多。當前的醫學管理在很大程度上不支持性靶向治療。幾種藥物包括 lopinavir-ritonavir,remdesivir,hydroxychloroquine,和azithromycin已在臨床試驗,但沒有一個被證明是確定的療法。更多的療法正在臨床試驗中進行測試。許多國家已採取社會隔離和封鎖措施,以減輕病毒的進一步傳播。在這裡,本文將回顧我們目前對COVID-19的了解,並考慮解釋異質症狀的潛在機制,特別是關注兒童和成人患者之間的差異。

圖1. COVID-19影響人體的機制
2. COVID-19的流行病學數據
迄今為止,大量的研究都是基於中國經驗的報告。爆發開始時,大多數老年人中觀察到了COVID-19病例。隨著疫情的繼續發展,65歲及65歲以上人群中的病例數進一步增加,但兒童(<18歲)中的病例數也有所增加。男性患者的數量最初較高,但是隨著病例數的增加,沒有觀察到明顯的性別差異。平均潛伏期為5.2天。平均的致死率為2.3%。利用武漢市兩家醫院的數據研究了院內死亡的危險因素。在多變量分析中,年齡較大,器官功能衰竭評估(SOFA)評分較高和入院時d-dimer >1 μg/mL是危險因素。在單變量分析中,冠狀動脈疾病,糖尿病和高血壓的存在也被認為是危險因素。武漢市對85位致命的COVID-19致命患者進行了研究,中位年齡為65歲,其中大多數患者死於多器官衰竭,因為呼吸衰竭,休克和ARDS的發生率分別為94%,81%和74%的情況分別為。與多器官衰竭的高發率相一致,在嚴重疾病中發現d-dimer高表現,纖維蛋白原和凝血酶時間延長。
在中國爆發後,SARS-CoV-2已在全球範圍內傳播。截至2020年4月上旬,報告的COVID-19患者人數在美國最高,其次是西班牙,義大利,德國,法國和中國。中國爆發後,義大利受到嚴重影響。與中國人一樣,老年人口的死亡率也較高。從義大利報告顯示為7.2%,是中國的三倍。儘管在義大利70歲以上的患者的病死率較高,但在兩個國家,0歲至69歲之間的病死率非常相似。由於23%的義大利人年齡在65歲或65歲以上,因此人口統計學特徵在一定程度上解釋了義大利高病死率的原因。
從疫情爆發開始,在COVID-19總患者中,兒童所佔的比例很小。根據中國疾病預防控制中心(China CDC)自2020年2月以來的數據,年齡小於10歲且年齡在11-19歲之間的兒童佔病例總數的1%。考慮到該年齡組佔總人口的20%,這可能表明COVID-19在兒科人群中的患病率較低。但是,如果由於症狀少而對兒童進行的檢查較少,則這可能是低估了兒科人群的實際發病率。一個令人困惑的因素是,由於農曆新年假期,大部分流行期間中國的學校都關閉了,這可能導致兒童的接觸減少。
來自中國疾病預防控制中心的2134名小兒COVID-19患者的報告分別被診斷為無症狀,輕度,中度或重度患者,分別為4.4%,50.9%,38.8%和5.9%。無症狀,輕度,中度,嚴重和嚴重的定義概述於表格1 。相反,成年患者中有18.5%患有嚴重疾病。嬰兒最容易受到嚴重感染。在<1、1-5、6-10、11-15和≥16歲年齡組中,重症和重症病例的比例分別為10.6%,7.3%,4.2%,4.1%和3.0%。0–9歲和10–19歲年齡組的病死率分別為0%。在義大利,8-18歲的COVID-19患者僅佔1.2%。0–9歲和10–19歲年齡組的病死率分別為0%和0.2%,這與中國人的經歷相似。
在3月下旬韓國疾病預防控制中心的數據中,所有經檢測COVID-19陽性的病例中有6.3%是19歲以下的兒童。2020年4月6日,美國疾病預防控制中心發布了針對18歲以下兒童的2572例COVID-19病例的研究。在美國所有報告的病例中,儘管該年齡組占美國人口的22%,但僅佔總病例的1.7%。總體而言,數據表明,與中國報導相比,兒童的症狀不如成年人。在可以獲得完整信息的兒童中,只有73%的兒童發燒,咳嗽或呼吸急促。相比之下,同期報告的18%至64歲的成年人中,這一比例為93%。1至17歲兒童的估計住院率最高為14%。相比之下,嬰兒住院的比例最高(15-62%),這再次與中國疾病預防控制中心的數據相似。儘管對兒科人群總體而言是有利的結果,但在美國和其他國家/地區已經報告了許多死亡病例,還需要獲得更多信息。
關於COVID-19的嚴重性,人們越來越關注疾病的嚴重性與性別之間的關係。雖然中國系列顯示男性和女性之間的案件數量相等。來自其他國家的數據也顯示了相似的結果。COVID-19的不良預後與合併症相關,包括高血壓,心血管疾病和肺部疾病。這些情況在男性中更為普遍,並且與吸煙和飲酒有關。指出基於性別的免疫學差異是另一種可能的解釋。此外,這項研究調查了影響採用保護性行為的因素的研究,特別是在大流行的情況下,發現女性進行非藥物性行為(例如洗手,使用口罩和避免人群)的可能性相對於男人增加了約50%,這可能是部分原因。

表1. COVID-19患者的分類。
3. SARS-CoV-2侵入宿主細胞的機制
冠狀病毒是約30 kb的有包膜,正股,單鏈RNA病毒。它們感染多種宿主物種。它們大致分為四個屬;基於其基因組結構的α,β,γ和δ。α和β冠狀病毒僅感染哺乳動物。人類冠狀病毒,例如229E和NL63,是造成普通感冒和人群的原因,屬於α冠狀病毒。相反,SARS-CoV,中東呼吸綜合徵冠狀病毒(MERS-CoV)和SARS-CoV-2被歸類為β冠狀病毒。

圖1. COVID-19的病毒結構
刺突蛋白Spike (S) protein,
膜蛋白membrane (M) protein,
包膜以及核衣殼蛋白envelop (E) and nucleocapsid (N) protein
Choices for Measuring Luciferase-Tagged Reporter Pseudotyped Viral Particles in Coronavirus Research
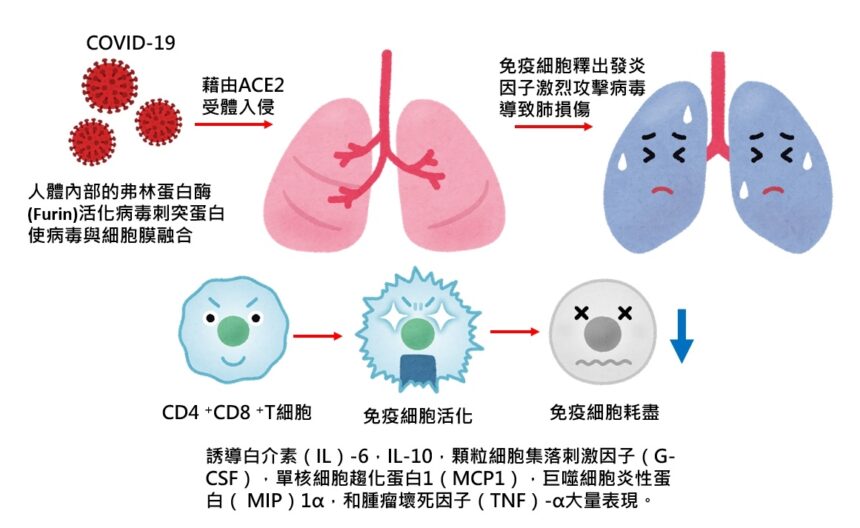
病毒與宿主的生命週期包括以下五個步驟:附著,滲透,生物合成,成熟和釋放。一旦病毒與宿主受體結合(附著),它們就會通過內吞作用或膜融合(穿透)進入宿主細胞。病毒內容物在宿主細胞內釋放後,病毒RNA進入細胞核進行複製。病毒mRNA用於製造病毒蛋白(生物合成)。然後,製造新病毒顆粒(成熟)並釋放。冠狀病毒由四種結構蛋白組成。刺突(S),膜(M),包膜(E)和核衣殼(N)。刺突由從病毒表面突出的跨膜三級糖蛋白組成,這決定了冠狀病毒的多樣性和宿主嗜性。刺突包含兩個功能性亞基。S1亞基負責與宿主細胞受體的結合,而S2亞基則負責病毒膜和細胞膜的融合。血管緊張素轉換酶2(ACE2)被確定為SARS-CoV的功能性受體。結構和功能分析表明,SARS-CoV-2的刺突也與ACE2結合。ACE2在肺,心臟,迴腸,腎臟和膀胱中高表現。
在肺中,ACE2在肺上皮細胞上高表達。SARS-CoV-2是否與其他靶標結合尚需進一步研究。SARS-CoV-2與宿主蛋白結合後,刺突蛋白經歷蛋白酶切割。提出了一個兩步驟的蛋白酶切割來活化SARS-CoV和MERS-CoV的刺突蛋白模型,該模型包括在S1 / S2切割位點切割以引發和在S’2切割位點活化。在S 2亞基內與融合肽相鄰的位置。在S1 / S2切割位點切割後,S 1和S 2亞基保持非共價結合,而遠端S 1亞基有助於在預融合狀態下將膜錨定的S 2亞基穩定化。隨後在S’2位點的切割可能通過不可逆的變化活化了用於膜融合的刺突。冠狀病毒刺突在病毒中是不常見的,因為一系列不同的蛋白酶可以切割並活化它。冠狀病毒中SARS-CoV-2的獨特特徵是S1 / S2位點存在弗林蛋白酶(Furin)切割位點(“ RPPA”序列)。SARS-CoV-2的S1 / S2位點在生物合成過程中完全受到切割,這與SARS-CoV刺突形成了鮮明的對比,而SARS-CoV刺突未進行切割就被組裝進了組裝物中。雖然S1 / S2位點通過其它蛋白酶也進行切割,例如跨膜絲氨酸蛋白酶2(TMPRSS2)和組織蛋白酶L,弗林蛋白酶的廣泛表達可能使得這種病毒非常致病。
4.宿主對SARS-CoV-2的反應
感染SARS-CoV-2的患者的症狀範圍從輕微症狀到嚴重的呼吸衰竭並伴有多器官功能衰竭。通過計算機斷層掃描(CT)掃描,即使在無症狀的患者中也可以看到特徵性的肺毛玻璃混濁。因為ACE2是高度表現在肺泡空間的肺上皮細胞,這種病毒可以有可能進入並破壞它們。這與早期肺損傷經常在遠端氣道中看到這一事實相吻合。上皮細胞,肺泡巨噬細胞和樹突狀細胞(DC)是氣道先天免疫的三個主要組成部分。DC位於上皮細胞下方。巨噬細胞位於上皮的頂側。DC和巨噬細胞作為先天免疫細胞與病毒抗爭,直到涉及到適應性免疫。
T細胞反應是由抗原通過DC和巨噬細胞呈遞而引發的。DC和巨噬細胞可以吞噬被病毒感染的凋亡細胞。例如,病毒感染的凋亡上皮細胞可以被DC和巨噬細胞吞噬,這導致抗原呈遞給T細胞。根據免疫基因組數據庫(http://rstats.immgen.org),ACE2在(脾)樹突狀細胞和肺泡巨噬細胞上的表達存在但受到限制。找到SARS-CoV-2另一種蛋白結合APC有助於回答這個問題。除ACE2以外,SARS-CoV還可以結合樹突狀細胞特異性細胞間粘附分子3-捕獲非整聯蛋白(DC-SIGN)和DC-SIGN相關蛋白(DC-SIGNR,L-SIGN)。DC-SIGN在樹突狀細胞和巨噬細胞上高表達。SARS-CoV-2的另一個目標(如果有的話)可以幫助病毒直接感染DC和肺泡巨噬細胞。這需要進一步的研究。這些抗原呈遞細胞移至引流淋巴結,將病毒抗原呈遞給T細胞。CD4 +和CD8 + T細胞起著至關重要的作用。CD4 +T細胞活化B細胞以促進病毒特異性抗體的產生,而CD8 + T細胞可以殺死病毒感染的細胞。
免疫學研究主要報導於重症COVID-19患者。重症患者的疾病表現出淋巴細胞減少,特別是在外周血T細胞。患有嚴重疾病的患者血漿中促炎細胞因子的濃度增加,包括白介素(IL)-6,IL-10,顆粒細胞集落刺激因子(G-CSF),單核細胞趨化蛋白1(MCP1),巨噬細胞炎性蛋白( MIP)1α,和腫瘤壞死因子(TNF)-α。患者病情越嚴重,其IL-6水平越高。CD4 +和CD8 +CD69,CD38和CD44的表達也較高,這些患者的T細胞被活化。CD4 +和CD8 + T細胞中較高的檢查點受體Tm3 + PD-1 +亞型百分比表明T細胞也已耗盡。NK組2的成員A(NKG2A),另一個標誌物在CD8 + T細胞上升高了。T細胞耗盡可能導致疾病進展。另一個有趣的發現是在嚴重疾病的COVID-19患者中發現了帶有共同表達的干擾素(IFN)-γ和顆粒細胞巨噬細胞集落刺激因子(GM-CSF)的異常致病性CD4 + T細胞。先前已經報導了從T細胞產生GM-CSF是對病毒感染的反應。GM-CSF可幫助區分先天免疫細胞並增強T細胞功能,但它可以引發過量的組織損傷。GM-CSF + IFN-γ + CD4 + T細胞先前在實驗性自身免疫性腦脊髓炎(EAE)模型中因T細胞受體(TCR)反應而見,其中發現表達GM-CSF的CD8 + T細胞百分比更高且分泌IL -6。值得一提的是,這些免疫學研究僅是由成年患者報告的。兒童的免疫反應需要另外調查。
對SARS-CoV的研究表明,受病毒感染的肺上皮細胞除IL-6外還產生IL-8。IL-8是嗜中性顆粒細胞和T細胞的眾所周知的化學引誘劑。在患有嚴重COVID-19名患者肺中觀察到了大量的炎性細胞浸潤。在先天免疫細胞中,我們期望大多數是嗜中性顆粒細胞。中性顆粒細胞可充當雙刃劍,因為中性顆粒細胞可誘發肺損傷。考慮到已報導循環T細胞顯著減少,觀察到的大多數浸潤性適應性免疫細胞可能是T細胞。CD8 + T細胞是原代細胞毒性T細胞。嚴重的患者還顯示出源自CD4 + T細胞的病理性細胞毒性T細胞。這些具有細胞毒性的T細胞可以殺死病毒,但也會導致。循環單核細胞對這些病理性T細胞釋放的GM-CSF有反應。CD14 + CD16 +炎性單核細胞亞群在健康對照中很少存在,並且在COVID-19患者中也以明顯更高的百分比被發現。這些炎症性CD14 + CD16 + 單核細胞具有高表達的IL-6,這可能會加速全身炎症反應的進程。
有趣的是,ACE2在先天性淋巴樣細胞(ILC)2和ILC3顯著表達。NK細胞是ILC1的成員,ILC1在肺中構成ILC的很大一部分(〜95%)。ILC2和ILC3用於黏液穩定。迄今為止,關於冠狀病毒感染中ILC2和ILC3的研究非常有限。
除呼吸道症狀外,在嚴重疾病中還觀察到血栓形成和肺栓塞。這與在嚴重疾病中觀察到的d-dimer和纖維蛋白原水平升高的發現相符。內皮的功能包括促進血管舒張,纖維蛋白溶解和抗聚集。由於內皮在血栓形成調節中起著重要作用,在嚴重疾病中見到的高凝狀態可能表明嚴重的內皮損傷。內皮細胞也表達ACE2。值得注意的是,內皮細胞佔肺細胞的三分之一。內皮損傷導致的微血管通透性可促進病毒侵襲。
5. COVID-19中兒童與成人之間差異的潛在解釋
由於呼吸道感染了呼吸道合胞病毒和流感病毒等病毒,嬰兒和幼兒通常有較高的入院風險。相反,與老年患者相比,兒童COVID-19患者通常具有相對較輕的症狀。兒童與成人之間存在這種差異的原因仍然難以捉摸。因為最近的報告提出了COVID-19的嚴重程度與病毒載量(或病毒脫落時間的持續時間)之間的相關性,所以即使他們感染了COVID-19,兒童的病毒載量也可能更少。在這方面,可以考慮幾個假設。
第一種可能性是成人和兒童之間ACE2的表達水平可能不同。先前的研究表明,ACE2在分化良好的纖毛上皮細胞中更豐富地表達。出生後人肺和上皮細胞繼續發育。ACE2表達可能在兒科人群中較低。從肺基因表達分析門戶網站(https://research.cchmc.org/pbge/lunggens/mainportal.html),小鼠中ACE2的表達在出生時就升高了。它的表達減少到P10左右,然後增加。由於嬰兒在兒童中易患嚴重疾病,因此這種模式可能與患者的臨床情況相符。另外,性別也可能影響ACE2的表達。ACE2基因位於X染色體上。男性循環中ACE2水平高於女性。這可能是造成成年人和兒童人群中男女嚴重程度和死亡率差異的部分原因。
第二種可能性是兒童對成年人對SARS-CoV-2病毒的反應在質上有差異。隨著年齡的增長,持續的抗原刺激和胸腺退化導致T細胞亞群的分佈從幼稚T細胞轉移到中央記憶T細胞,效應T細胞和效應記憶T細胞。這個過程伴隨著諸如CD27和CD28之類的共刺激分子表達的喪失,對感染的敏感性增加。目前尚不清楚在患有嚴重COVID-19疾病的成年患者中病理性T細胞的出現是否是由於這種基本衰老過程的補償所致。出生後早期,CD4 +T細胞在Th1相關促炎細胞因子的產生中受損,並偏向Th2。CD8 + T細胞減少細胞毒性和炎症介質的表達。出生後早期對T細胞的殺傷能力較低,這可能解釋了嬰兒對SARS-CoV-2的易感性。比較感染了SARS-CoV的老年和幼年獼猴的研究表明,老年獼猴具有更強的促炎反應和更差的肺部病理學。據報導,使用SARS-CoV感染的老年小鼠和年輕小鼠也有類似結果。嚴重的COVID-19感染的特徵是大量的促炎反應或細胞因子風暴,從而導致ARDS和多器官功能障礙(MODS)。也有人認為成人和兒童的炎症反應有很大的不同。衰老與控制中性顆粒細胞功能的促炎性細胞因子的增加有關,並且與ARDS的嚴重程度相關。到目前為止,尚無SARS-CoV-2的動物模型,但我們希望將來能看到臨床前模型。
第三種可能性是,在幼兒中常見的黏膜肺和氣道中同時存在其他病毒可以使SARS-CoV-2病毒與其競爭並限制其生長。在這一點上,我們還沒有研究測試各種病毒以及SARS-CoV-2來確定這種可能性。
相反,這些可能性的組合可以解釋兒童和成人的COVID-19表型。了解為什麼一般兒童對嚴重COVID-19較不敏感,將有助於設計免疫療法來根除此病毒。
6. 結論
COVID-19的大流行是一個現實問題,影響著全世界的人們。沒有基本的治療方式,當前的管理方法是減少病毒傳播並為患病患者提供支持治療。迫切需要開發靶向療法。了解兒童和成人對此病毒反應的差異可能有助於免疫方面的治療方法。
COVID-19 pathophysiology: A review
參考文獻
Yuki, K., Fujiogi, M., & Koutsogiannaki, S. (2020). COVID-19 pathophysiology: A review. Clinical immunology, 108427.