根據台灣在2020年12月底的人口統計調查資料,45-65歲以上的失智人口超過30萬人。約佔全國總人口1.3 %,即在台灣約每77人中即有1人是失智者。失智症泛指有關記憶喪失以及足以嚴重干擾日常生活的能力問題,而失智症中以阿茲海默症(Alzheimer’s disease, AD)最為普遍,佔全球所有失智症病例的60-70% (全球約有5千萬病例),它是一種大腦疾病,造成不正常的老化現象,該病造成之看護成本巨大,估計全球每年超過一兆美元在阿茲海默症患者身上,對於家庭與社會帶來沉重負擔。從研究預測中提出 2050 年,失智症患者總數預計抵達1.52億人口,因此預防與介入治療開始被重視。
然而目前沒有治癒失智症的方式,而有些治療可以改善症狀,本篇會介紹失智症最普遍的阿茲海默症的病理、成因假說以及目前的治療方式。
阿茲海默症患者的臨床病理演變: 患者症狀演變可分為以下四階段
- 臨床前或症狀前階段:此時期患者會有輕度的認知障礙,時間持續數年或更長,皮質與海馬迴出現早期病理變化,但日常生活尚無障礙,也沒有阿茲海默症臨床症狀。
- 阿茲海默症輕度或早期階段:此時患者開始出現多種症狀,如注意力不集中、記憶力下降、時間和地點迷失、情緒變化以及憂鬱症等。
- 阿茲海默症中期階段:病徵擴散到大腦皮質,記憶喪失增加,難以識別家人和朋友,喪失衝動控制,閱讀、寫作和說話困難等語言障礙。
- 阿茲海默症晚期或重度階段:病徵擴散到大腦皮質全體區域,神經炎斑塊和神經原纖維纏結嚴重堆積,導致漸進型功能和認知障礙,患者完全認不出家人並可能因吞嚥和排尿困難而臥床不起,最終導致患者因這些併發症而死亡。
阿茲海默症的成因假說
阿茲海默症被認為是與多種風險因素相關的多因素疾病,例如年齡增長、遺傳因素、頭部受傷、血管疾病、感染和環境因素(重金屬、微量金屬等)。成因假說的其中兩個被認為是主要原因:1. 膽鹼能假說,2. 類澱粉蛋白假說。然而,目前還沒有公認的理論來解釋阿茲海默症的發病機制。
- 膽鹼能假說
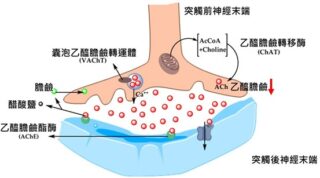
在 1970 年代,針對皮質和突觸研究發現乙醯膽鹼( Ach) 在認知功能中的重要作用,提出了阿茲海默症的膽鹼能假說。乙醯膽鹼ACh 在膽鹼能神經元的細胞質中由膽鹼和乙醯輔酶 A 通過 ChAT 酶合成,並通過囊泡乙醯膽鹼轉運蛋白 (VAChT) 轉運到突觸小泡。在大腦中,乙醯膽鹼參與多種生理過程,例如記憶、注意力、感覺信息、學習和其他關鍵功能。發現膽鹼能神經元的退化發生在 AD 中並導致認知功能和記憶喪失的交替。

圖1. 在突觸前和突觸後神經末梢之間合成和運輸乙醯膽鹼的途徑。由於大腦皮層中的突觸前膽鹼能標誌物減少、基底前腦 Meynert 基底核 (NBM) 的嚴重神經病變,導致乙醯膽鹼表現下降。
- 類澱粉蛋白假說
而後的研究發現中樞神經系統中β-折疊的異常沉積與失智有很強的相關性,從而產生了類澱粉蛋白假說的概念。然而,發現類澱粉蛋白斑塊(AP)也隨著年齡的增長而沉積在正常健康的大腦中,這提出了 AP 沉積是否與 AD 發病有關?β-類澱粉蛋白被認為影響膽鹼能神經傳遞並導致膽鹼攝取減少和乙醯膽鹼釋放。研究發現,膽鹼能突觸丟失和類澱粉蛋白原纖維形成與 Aβ 寡聚體的神經毒性以及 AChE 和 Aβ 肽之間的相互作用有關。

圖2. APP 是一種穿透神經元膜的跨膜蛋白。APP 對神經元生長、存活和損傷後修復至關重要。在阿茲海默病中,γ 分泌酶和β 分泌酶在蛋白水解過程中共同作用,導致 APP 被分成更小的片段。其中一個片段會產生β澱粉樣蛋白原纖維,然後形成團塊,這些團塊在神經元外以緻密的形式沉積,稱為類澱粉斑塊。
- 其他因素:
例如位於突觸前膽鹼能末端的菸鹼和毒蕈鹼 (M2) Ach 受體減少,以及興奮性胺基酸 (EAA) 神經傳遞的缺陷,其中谷氨酸濃度和 D-天門冬胺酸攝取AD 大腦的許多皮層區域顯著減少。這是在使用膽鹼能受體拮抗劑(如東莨菪鹼)的基礎上發現的,東莨菪鹼可誘發健忘症。
阿茲海默症的風險因素
- 老化
阿茲海默症中最重要的風險因素是衰老,大多數阿茲海默症病例在 65 歲以後開始發病。衰老是一個複雜且不可逆的過程,它通過多個器官和細胞系統發生,伴隨著大腦體積和重量的減少、突觸的喪失以及特定區域的腦室擴大,並伴有 SP 沉積和 NFT。此外,衰老過程中可能會出現幾種情況,例如葡萄糖代謝減退、膽固醇平衡失調、粒線體功能障礙、憂鬱和認知能力下降。這些變化也出現在正常衰老中,這使得在 阿茲海默症早期很難區分病例。阿茲海默症中早發性阿茲海默症(EOAD),比較罕見約佔1-6%的病例,大多數是家族性阿茲海默症,年齡範圍為 30- 65 歲。第二種是一般的阿茲海默症也稱遲發性AD(LOAD),即發病年齡在65歲以上。
- 遺傳因素
70% 的 阿茲海默症病例與遺傳因素有關:大多數 EOAD 病例以常染色體顯性遺傳模式遺傳,並且澱粉樣前體蛋白 (APP)、早老素-1 (PSEN-1)、早老素-2等顯性基因發生突變(PSEN-2)和載脂蛋白 E (ApoE) 與 AD 有關。
- 心血管疾病 (Cardiovascular Disease, CVD)
心血管疾病被認為是阿茲海默症的一個重要危險因素,例如中風與神經組織丟失導致的失智風險增加有關,這會增強退行性效應並影響類澱粉蛋白和 tau 病理學。心房顫動還會引起栓塞,從而導致中風以及記憶力和認知功能下降。此外,心力衰竭影響心臟的泵血功能,導致身體供血不足和大腦灌注不足,導致缺氧和神經損傷。冠心病的研究發現,動脈粥狀硬化、外周動脈疾病、低血流量和血栓都與 阿茲海默症風險增加有關。高血壓與血管壁增厚和管腔變窄有關,這會降低腦血流量,在慢性病例中,它可能引起腦水腫,這些都是阿茲海默症的危險因素。
阿茲海默症尚無有效治療藥物
截至目前,只有兩類藥物被批准用於治療阿茲海默症,包括乙醯膽鹼酯酶抑製劑(天然衍生、合成和混合類似物)和N-甲基d -天門冬胺酸拮抗劑(NMDA)。儘管這兩類藥物具有治療作用,但它們僅對治療 AD 症狀有效,而不能治癒或預防疾病。

圖3. 目前衛福部許可的阿茲海默症治療藥物。
研究人員已經提出了幾種機制來了解 AD 病理學以改變其途徑並開發治療方法,包括異常 tau 蛋白代謝、β-類澱粉蛋白、發炎反應以及膽鹼能和自由基損傷等。
阿茲海默症的早期介入與預防
幾項研究表明,多領域干預包括改變生活方式(地中海飲食、運動、認知訓練和智力活動練習)和控制心血管危險因素,可有效降低風險因素發生,因此減少炎症以促進大腦健康減低或延緩失智症發生是我們可以做的積極預防措施。
天然提取物-菇類的麥角硫因胺基酸(Ergothioneine)
長期以來,天然化合物已被用作多種病理疾病的治療劑,最近的研究表明它們具有神經保護作用。體外和體內研究證明,天然化合物具有治療失智症的潛力,這使得其中一些進入臨床試驗階段。
麥角硫因富含在菇類,研究指出餵食杏鮑菇的小鼠六週後有效改善了小鼠的記憶缺陷且對體重增加、食物攝入效率、血清生化參數和肝腎組織病理學特徵均無不良影響。杏鮑菇顯著降低腦磷酸化 τ (tau) 蛋白、Aβ 斑塊沉積、丙二醛和蛋白羰基表現 ( p < 0.05)。因此,杏鮑菇中麥角硫因可以促進 Aβ 誘導的 AD 小鼠模型的記憶和學習能力。(SCI-HUB也沒pdf)
在猴頭菇發酵菌絲體PHEB多醣治療AD小鼠的實驗中,PHEB 治療 AD 小鼠的腦損傷、β 類澱粉蛋白沉積和 tau過度磷酸化得到緩解,其他組織沒有變化。PHEB緩解氧化應激通過調節 Nrf2 及其下游激酶在 AD 小鼠的大腦中,進一步改善了膽鹼的功能。

圖4. 以不同濃度的PHEB(25或100 mg/kg )治療小鼠,腦組織切片中,100mg濃度能降低β 類澱粉蛋白沉積和 tau過度磷酸化。
麥角硫因(Ergothioneine, ERG)也被證實在小鼠上能阻止Aβ在海馬中的積累和腦脂質過氧化,恢復乙醯膽鹼 (ACh) 活性。保護小鼠免受Aβ誘導的記憶和學習能力喪失。研究指出老年人的全血麥角硫因表現在60歲以後顯著下降。此外,患有輕度認知障礙的受試者中的一部分血漿麥角硫因表現顯著低下。表示麥角硫因缺乏可能是一個危險因素,使個體易罹患神經退化性疾病。
麥角硫因表現較低與血管性失智顯著相關。較低的麥角硫因表現還與白質高信號以及腦萎縮標誌物(減少全球皮質厚度和海馬體積)有關。低表現的麥角硫因與疾病嚴重程度相關,並且可能是認知障礙的潛在生物標誌。麥角硫因的缺乏可能導致神經病變和血管性失智相關的認知障礙。因此,麥角硫因在研究上被稱為衰老和失智的生物標誌物,麥角硫因等自由基清除劑的低下可能會促進失智和衰老相關事件的進展。一些研究支持補充麥角硫因可減輕實驗動物模型中的認知障礙和組織氧化損傷的觀點。因此,麥角硫因是降低衰老和失智的潛在介入方法。
根據日本的臨床實驗,對 52 名健康志願者(18 名男性和 34 名女性,包括輕度認知障礙者)進行了一項隨機、安慰劑對照、雙盲、平行組研究。受試者食用5 mg 麥角硫因的錠劑(金頂側耳萃取)作為測試食物,對照組為不含麥角硫因的安慰劑。並以Cognitrax 測試針對4、8 和 12 週後的認知功能評估,與安慰劑組相比,食用上述劑量之金頂側耳萃取的麥角硫因組在語言記憶、簡單注意力和持續注意力方面有顯著改善。在研究期間,在任何受試者中均未觀察到可歸因於測試食物的不良事件。結果表明,持續攝入麥角硫因可改善正常受試者和輕度認知障礙者的認知功能。

圖5. 比較試驗產品與安慰劑的記憶力測試,與安慰劑比較有顯著差異*P<0.05。與第0周相比有顯著差異 (‡P<0.01)。
此外,天然提取物通過作用於多種機制的途徑,在治療 阿茲海默症方面顯示出巨大的潛力。總之,阿茲海默症治療的成功取決於其早期治療和患者使用生物標誌物診斷監測疾病進展,自我飲食及生活習慣控制也是降低失智症風險因子發生的積極途徑之一。
參考文獻
台灣失智症協會-台灣失智症人口推估 (2022/04/05)
Breijyeh, Z., & Karaman, R. (2020). Comprehensive review on Alzheimer’s disease: Causes and treatment. Molecules, 25(24), 5789.
Alzheimer’s disease (2022/4/14)
Beshir, S. A., Aadithsoorya, A. M., Parveen, A., Goh, S. S. L., Hussain, N., & Menon, V. B. (2022). Aducanumab Therapy to Treat Alzheimer’s Disease: A Narrative Review. International Journal of Alzheimer’s Disease, 2022.
Yang, N. C., Lin, H. C., Wu, J. H., Ou, H. C., Chai, Y. C., Tseng, C. Y., … & Song, T. Y. (2012). Ergothioneine protects against neuronal injury induced by β-amyloid in mice. Food and chemical toxicology, 50(11), 3902-3911.
Cheah, I. K., Feng, L., Tang, R. M., Lim, K. H., & Halliwell, B. (2016). Ergothioneine levels in an elderly population decrease with age and incidence of cognitive decline; a risk factor for neurodegeneration?. Biochemical and Biophysical Research Communications, 478(1), 162-167.
Wu, L. Y., Cheah, I. K., Chong, J. R., Chai, Y. L., Tan, J. Y., Hilal, S., … & Lai, M. K. (2021). Low plasma ergothioneine levels are associated with neurodegeneration and cerebrovascular disease in dementia. Free Radical Biology and Medicine, 177, 201-211.
Kondoh, H., Teruya, T., Kameda, M., & Yanagida, M. (2022). Decline of ergothioneine in frailty and cognition impairment. FEBS letters.
Liang, C. H., Huang, P. C., Mau, J. L., & Chiang, S. S. (2020). Effect of the king oyster culinary-medicinal mushroom Pleurotus eryngii (Agaricomycetes) basidiocarps powder to ameliorate memory and learning deficit in ability in Aβ-induced Alzheimer’s disease C57BL/6J mice model. International Journal of Medicinal Mushrooms, 22(2).
Hu, W., Song, M., Wang, C., Guo, Z., Li, Y., & Wang, D. (2021). Structural characterization of polysaccharide purified from Hericium erinaceus fermented mycelium and its pharmacological basis for application in Alzheimer’s disease: Oxidative stress related calcium homeostasis. International Journal of Biological Macromolecules, 193, 358-369.
渡邉憲和. (2020). 健常者および軽度認知障害者に対するエルゴチオネイン含有食品の認知機能改善効果―ランダム化プラセボ対照二重盲検並行群間比較試験―. 薬理と治療, 48(4), 685-697.