EGCG在商品上被稱作綠茶素,是兒茶素(Catechin)的一種,兒茶素可以分為表兒茶素(Epicatechin EC)、表沒食子兒茶素(Epigallocatechin EGC)、表兒茶素沒食子酸酯(Epicatechin gallate ECG)和表沒食子兒茶素沒食子酸酯(Epigallocatechin gallate EGCG)主要這四種型態。
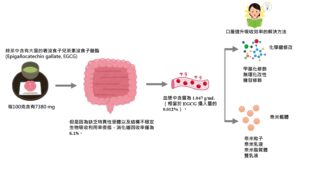
而EGCG是茶中含量最豐富的兒茶素,約佔綠茶中兒茶素的 40%。它在綠茶中每100克含有7380 mg,白茶每100克含有4245 mg,紅茶中每100克含有936 mg。EGCG的生物活性來源於大量具有活性的酚羥基,廣泛應用於食品工業。近年來,一些研究證實EGCG具有良好的保健作用,包括抗氧化作用和抗腫瘤。許多研究已經證實EGCG的生物利用度與其穩定性有關。而EGCG的最大缺點在於生物利用度低,即使每天喝下相當於 8-16 杯綠茶(一杯100ml)的量,EGCG 的吸收也很差,這個量會導致噁心或胃灼熱等不良反應。穩定性差是利用率低的一個重要原因。
另外2018 年的一項審查表明,過量攝入 EGCG 可能會導致肝毒性。歐洲食品安全局表示,每日攝入 800 mg或更多可能會增加肝損傷的風險。大鼠研究顯示,肝臟中的 EGCG 濃度大約是血漿中的四倍。在肝臟中可以看到毒性作用,而對其他器官或組織沒有任何毒性作用。抗氧化劑可能會降低 EGCG 的毒性作用。
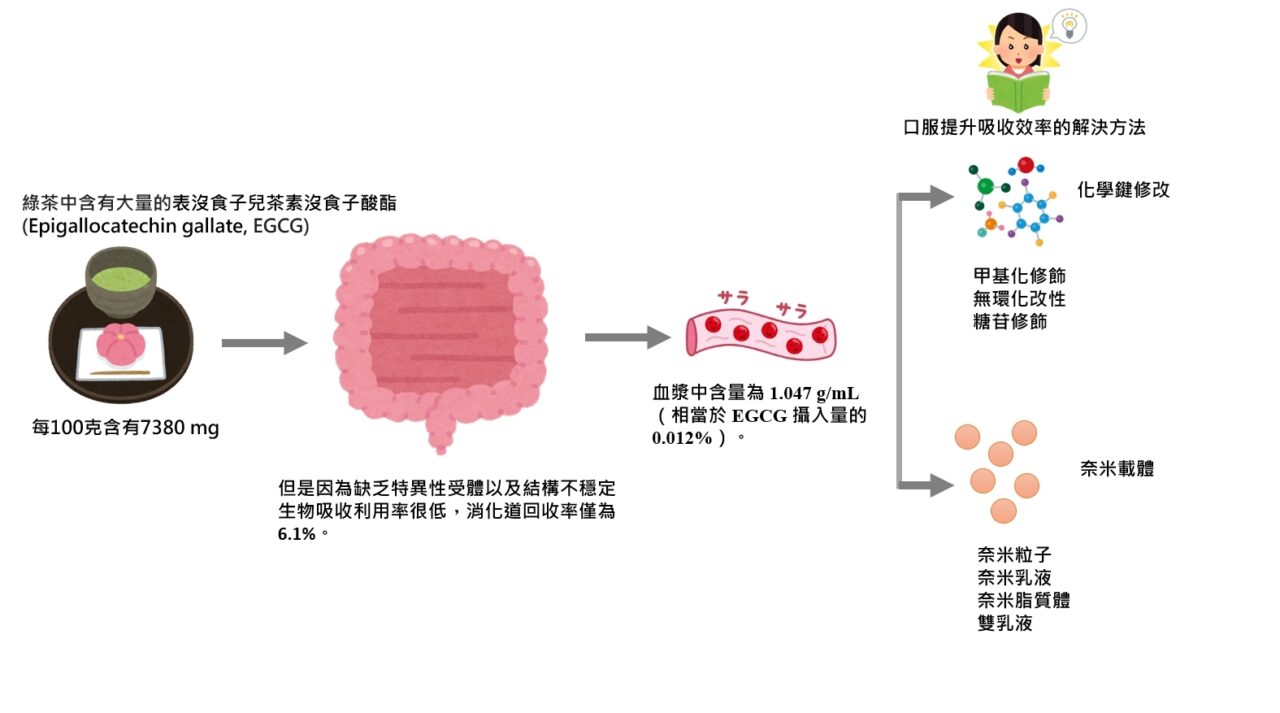
圖1. EGCG在保健品應用上的問題與解決方案。
關於EGCG的代謝研究
口服EGCG的生物利用度相對較差。EGCG通常通過胃腸道吸收到血液中發揮其生物學作用。根據過去的研究,兩杯綠茶進入人體後,EGCG的最高血漿濃度僅為0.15μM。而口服EGCG腸道吸收有限的主要因素如下:
(1)EGCG腸道環境穩定性差。
(2)腸道吸收率低。

圖2. EGCG在人體中的代謝情況,大部分都被排出或分解無法有效地吸收。
在腸道穩定性差的研究
EGCG雖然具有良好的生物活性,但提高其口服利用率的效果並不理想。有研究表明EGCG在高溫、中性或弱鹼條件下容易發生氧化分解,且降解速度隨著環境溫度和氧化濃度的升高而加快。此外,腸道pH值可能是影響口服EGCG穩定性的重要因素之一。特別是綠茶中的兒茶素在唾液、胃和上腸的消化過程中非常不穩定。兒茶素總回收率很低(5.3%),EGCG顯著下降,消化道回收率為6.1%。在模擬胃液3 h條件下,EGCG溶液殘留量達到92.2%。在模擬腸液的過程中,EGCG的殘留量在0.5 h內下降了50%,但在1.5 h內僅下降了3.4%。兩小時後,未檢測到EGCG含量。
特別是EGCG在腸道pH條件下不穩定,容易分解。據報導,游離EGCG在模擬腸道pH消化中的保留率小於10%。一些相關研究表明,在模擬胃pH消化後,49.03%的游離EGCG被保留,而 20% 的游離 EGCG 在模擬腸道 pH 下消化後保留。此外,腸道微生物對EGCG穩定性的影響也至關重要。結果表明,腸道菌群可以在體外和體內解離和降解EGCG。例如,在豬盲腸模型中,EGCG 在 4-8 小時內幾乎完全被豬腸道微生物中代謝掉。另一項研究報導,口服同位素標記的EGCG 4 h後,大鼠血液和大部分組織中的放射性保持在較低水平,8 h後增加,24 h內達到最高水平。EGCG被腸道微生物水解成EGC和沒食子酸。支持了EGCG在吸收之前經歷了腸道微生物代謝的論點。因此,EGCG的化學不穩定性會降低腸道吸收並影響其生物利用度。
腸道吸收度低的研究
口服生物利用度也與腸道吸收效率有關。EGCG在腸內的滯留時間和滲透性影響EGCG的吸收。通透性差是由於被動擴散和主動流出導致腸道轉運不良。在腸上皮細胞表面未發現攜帶EGCG進入細胞的特異性受體。因此,EGCG通過上皮細胞的傳遞機制主要是被動擴散,包括非細胞以及跨細胞擴散。吸收後,大部分 EGCG 通過主動射流回到空腔。大量研究表示,在攝入過程中存在一些外排蛋白Caco-2 細胞分泌 EGCG,可將 EGCG 從細胞中排出,減少細胞對 EGCG 的吸收。對於EGCG通過口腔進入Caco-2 (人類結腸腺癌)細胞的方式,很多結果表明EGCG具有外排作用,相關外排蛋白的表達增強。很明顯,MRP1 和 MRP2 參與了 EGCG 的流出。
血腦屏障通透性的研究
血腦屏障(BBB)是一種選擇性擴散屏障,可以限制血液中的某些物質進入腦組織,維持一個相對恆定的內部環境。口服後,EGCG在小腸微生物環境中代謝為GA和EGC,而生成的EGC在大腸環境中進一步分裂為EGC-M5。研究結果報告了 0.5 h 內 EGCG 的 BBB 滲透性。與分子尺寸較小的GA(MW170.12)相比,分子尺寸大的EGCG(MW458.372)、EGC(MW306.27)和EGC-M5(MW208.07)的BBB滲透率分別降低了57.54%、47.35%和分別為 43.31%。結果顯示,EGCG及其代謝物的分子量較小,滲透性較高。此外,EGCG的血腦屏障通透性也可能受疏水性的影響;較少的極性分子能讓腦組織有更多的吸收。因此,EGCG的結構修飾不僅可以提高EGCG在胃腸道中的穩定性,而且影響其吸收。
口服EGCG的分佈與代謝
口服EGCG通過胃進入腸道。進入腸道的部分EGCG被吸收到血液中,然後輸送到其他器官或部位。因此,只有部分EGCG能發揮其生物學功能。大多數EGCG通過膽汁進入排泄系統,然後排出體外。EGCG大部分不被腸道吸收,進入大腸,隨糞便排出體外。從口服到排泄,只有少數EGCG具有生物學效應。
有研究表明,飲茶後唾液中檢測到EGCG含量為4.8~22 g/mL。EGCG 可以被小腸吸收,並轉化到肝和腸細胞。它主要是由代謝酶II誘導的甲基化、硫酸化和葡萄醣醛酸代謝物引起的。EGCG的甲基化由兒茶酚-O-甲基轉移酶(COMT)催化。特別是,EGCG 被 COMT 甲基化形成 4′-O-methyl-EGCG、4”-Omethyl-EGCG 和 4′-4”-di-O-methyl-EGCG 代謝物。EGCG 在體外也顯示出抑制 COMT 活性。然而,最近一項關於健康志願者的研究禁食一晚後單劑量(750 毫克)EGCG 證明紅細胞中測量的 COMT 活性沒有受到抑制。高垣等人。報導EGCG 被腸道微生物水解成EGC 和沒食子酸。據報導,大鼠口服EGCG同位素標記4h後,血液和大部分組織的放射性仍然很低,8h後增加,24h後達到最高水平。
另一項研究報導,EGCG 的血液濃度在攝入後 1 至 2 小時達到峰值,此時口服 EGCG 被腸道吸收。禁食大鼠和人血漿中 EGCG 的最高濃度分別為 0.156 g/mL(相當於 EGCG 攝入量的 0.32%)和 1.047 g/mL(相當於 EGCG 攝入量的 0.012%)。據報導,EGCG在血漿樣品中主要以硫酸鹽的形式存在。然而,一些研究也證實了血液中EGCG甲基化、葡萄醣醛酸化和硫酸化的代謝途徑。
在血漿和尿液中發現了 EGCG (4,4″-diMeEGCG) 的二甲基代謝物。特別是,甲基化是主要的代謝途徑。其代謝物為4′-O-甲基-EGCG、4′,4′-二甲基-EGCG-3′-葡萄醣醛酸、3′,4′-或3′,5′-二甲基-EGCG-4′-O-葡萄醣醛酸酸(萬,2006)。EGCG主要以硫酸鹽形式存在於血漿樣品中。一些研究發現,只有少量 EGCG(約佔口服總劑量的 1%)可以進入人體循環系統。
有研究推測,攝入的EGCG大部分沒有進入血液,而是先從膽囊進入結腸,然後排出體外。另外,由於血液的弱鹼性環境,即使是進入血液的EGCG也不能充分利用。EGCG在肝臟中酸化形成EGCG-4″-O-葡萄醣醛酸複合物。EGCG 可以通過肝臟從血液中去除並分泌到膽汁中。EGCG 未經吸收或經腸肝循環通過小腸然後大量分解,最有可能被結腸細菌代謝成環裂解代謝物。一般情況下,近50%的EGCG從迴腸液中回收,但可能完全不被吸收。大約1%的迴腸液是二次結合物,但它可能直接從腸細胞排出,而不是腸-肝循環的結果。排出EGCG的主要途徑是膽汁排泄。尿液中代謝物的總量與最大血漿濃度有關。一些茶兒茶素的回收率為 0.5-0.6%。
改善EGCG利用率的解決方案
為了解決這些問題,科學家們找出了幾種解決方案。第一種是修改化學結構,通過結構修飾來提高EGCG的口服生物利用度。第二種是利用食品奈米輸送,基於一些食品奈米材料將生物活性物質或成分嵌入其內部或吸附材料的表面,以保護其免受胃腸環境的影響,從而達到穩定、持續的目的。釋放和提高生物活性。第二種由於不需用化學藥劑改變EGCG的特性而有廣泛的研究。
甲基化修飾
甲基化修飾是指將EGCG苯環上的8個酚羥基全部或部分轉化為甲醚而形成的一系列衍生物,也稱為醚化。甲基化後EGCG的溶解性和穩定性得到改善。其在動物血液中的穩定性明顯高於EGCG,口服吸收率是EGCG的9倍。體內活性試驗表明,當羥基被更穩定的親脂性甲氧基取代時,衍生物的穩定性和脂溶性也得到改善,從而使衍生物的生物利用度顯著提高,表現出很強的生物活性。其他研究表明,EGCG3”Me 對血管緊張素l 轉換酶活性具有顯著的抑製作用,具有高吸收率和血液穩定性。
無環化改性
酰化修飾可以選擇性地與酰基連接,在EGCG分子的八個酚羥基上形成酯鍵。化學酰化法主要是將兒茶素分子中的酚羥基與酰氯等酰化試劑反應生成酚酸酯,從而降低其水溶性,提高其脂溶性。兒茶素酚羥基含量高,氧化還原電位低,氧化損傷快,抗氧化時間短。當分子與脂肪鏈相連時,兒茶素的穩定性增加。大量長鏈脂肪酸酰化EGCG衍生物的活性研究表明,隨著脂溶性的增加,細胞膜通透性增加引起的抗氧化活性也增加。長鏈酰基的空間位阻效應會影響反應周圍酚羥基的參與。長鏈脂肪易聚集沉澱,導致部分長鏈脂肪酸酰化EGCG脂溶性降低。以乙烯基酯為酰基,得到EGCG酰化產物以增加其通過酶促分子修飾的脂溶性。乙酰化EGCG在油中的抗氧化活性高於未改性EGCG。使用乙酸酐合成乙酰化 EGCG。由於酚羥基被酰基保護,完全乙酰化的EGCG的穩定性比EGCG高6倍。乙酰化的EGCG在酯酶作用下逐漸水解為二酯和單酯在生物細胞中,使MCF7乳腺癌細胞抑制蛋白酶體和誘導凋亡的活性強於EGCG。特別是,口服全乙酰化 EGCG 使 EGCG 的血漿表現量增加了 2.4 倍。
糖苷修飾
糖苷修飾是指一種或多種親水性單醣選擇性連接到 EGCG 的八個酚羥基上。目前最常見的修飾是3′-OH的修飾。修飾的EGCG的水溶性增強,可以富集細胞質,清除多餘的自由基,促進細胞代謝。以sucrose-6-glucosyltransferase催化蔗糖與EGCG反應,得到EGCG-7-O-α-D-吡喃葡萄糖苷,EGCG-4′-O-α-D-吡喃葡萄糖苷和 EGCG-7,4′-O-α-D-吡喃葡萄糖苷的水溶性分別比 EGCG 高 49、55 和 114 倍。以 D-葡萄糖和 EGCG 為底物合成了 2,3,4,6-四-O-乙酰基-α-D-吡喃葡萄糖基溴。獲得EGCG-4”-O-β-D-吡喃葡萄糖苷(EGCG-G1)和EGCG-4′,4”-O-β-D-吡喃葡萄糖苷(EGCG-G2)。此外,EGCG 苷的水溶性增加:EGCG-G1 和 EGCG-G2 分別比可溶性 EGCG 高 31 倍和 15 倍。
| 輸送系統 | 包覆材料 | 製備方法 | 特徵 | 口服EGCG對生物利用度的影響 |
| 奈米粒子 | β-乳球蛋白 (β-lactoglobulin) | – | 尺寸:<50 奈米;ZP:-40 mV;EE:60–70% | 保護胃內的EGCG,並在腸道內持續釋放。 |
| 殼聚醣H-2鐵蛋白 (Chitosan H-2 ferritin) | 自組裝 | 尺寸:~330 nm;ZP:-; EE:9.69% | 基於Caco-2細胞提高EGCG在模擬胃腸道中的穩定性。 | |
| 殼聚醣酪蛋白磷酸肽 (Chitosan Casein phosphate peptide) | 離子凝膠 | 尺寸:~150 nm;ZP:~32.2 mV;EE:- | 基於Caco-2細胞提高EGCG的腸道通透性和生物利用度,對吸收過程表現出劑量和時間依賴性。 | |
| 殼聚醣聚(γ-谷氨酸)(Chitosan poly(gamma-glutamic acid)) | 自組裝 | 尺寸:123.6 ∼ 150.4 nm;ZP:22.9 ∼ 35.6 mV;EE:- | 增加EGCG的細胞外轉運,提高兒茶素的利用效率。 | |
| 殼聚醣三聚磷酸 (Chitosan tripolyphosphoric acid) | 自組裝 | 尺寸:~440 nm;ZP:~25 mV;EE:- | 提高EGCG的腸道吸收。暴露於血漿和空腸腔的 EGCG 量分別增加了 1.5 和 2.3 倍。 | |
| 奈米乳液 | 向日葵油Tween 80 (Sunflower oil Tween 80) | 高壓均質 | 尺寸:~280 nm;ZP:-; EE:83.16±1.12% | SGF 下緩慢持續釋放 |
| 玉米油聚山梨醇酯 80 (Corn oil Polysorbate 80) | 高壓均質 | 尺寸:~99.42 nm;ZP:−23.4 mV;EE:- | EGCG在負載奈米乳的茶多酚中的吸收顯著增加了28.6%。 | |
| 大豆蛋白葵花籽油 (Soy protein sunflower oil) | 高壓均質 | 尺寸:~260 nm;ZP:~28 mV;EE:- | 主要的兒茶素奈米乳化劑的生物利用度超過 2.78 倍。 | |
| 奈米脂質體 | 硫酸葡聚醣兩親殼聚醣 (Dextran sulphate amphiphilic chitosan) | 薄膜蒸發 | 尺寸:~189.8 nm;ZP:−40.6 mV;EE:90.8% | 表現出緩釋性能,能有效減緩SIF中EGCG的降解。 |
| 磷脂酰膽鹼膽甾酮 (Phosphatidylcholine Cholestenone) | 反相蒸發 | 尺寸:~180 nm;ZP:-; EE:85.79 ± 1.65% | 具有良好的胃腸穩定性,並且濃度依賴於 Caco-2 細胞的攝取。 | |
| 雙乳液 | 甘油單硬脂酸酯聚甘油聚蓖麻油酸酯 (glycerin monostearate polyglycerol | 高壓均質 | 尺寸:~507nm;ZP:-;EE:>80% | 增加Caco-2細胞對EGCG的吸收,在大鼠藥物動力學研究中比EGCG高1.93倍。 |
表格1. EGCG的奈米傳輸系統,ZP:Zeta 電位;EE:封裝效率;SIF:模擬腸液。
奈米粒子
奈米顆粒載體具有較大的表面積,有利於增加營養物質與吸附生物膜的接觸面積,改善奈米顆粒的特殊表面性質,大大延長奈米顆粒在小腸中的滯留時間。奈米顆粒對營養物質具有保護作用,可顯著提高營養物質的吸收和生物利用度。通過用β-乳球蛋白熱改性製備的奈米顆粒包覆EGCG,提高了EGCG在模擬胃腸消化過程中的穩定性。研究組製備包埋玉米蛋白的包埋EGCG殼聚醣奈米顆粒。複合奈米顆粒起到了控制釋放和更好的DPPH清除活性的作用。EGCG鐵蛋白-殼聚醣雙層奈米粒子和殼聚醣對鐵蛋白的保護作用明顯,EGCG分子在鐵蛋白-殼聚醣雙層薄膜包衣中的穩定性明顯提高。Caco-2細胞的轉運結果表明奈米顆粒對鐵蛋白具有顯著的保護作用。尤其是雙層包衣更有利於EGCG的攝取。製備含有殼聚醣-酪蛋白-磷酸肽奈米顆粒的 EGCG。Caco-2 細胞內綠色熒光的細胞攝取結果證實負載有 EGCG 的奈米顆粒被內化到細胞中。EGCG 在孵育時間和濃度範圍內的吸收是劑量和時間依賴性的。此外,表面帶電荷的殼聚醣和聚谷氨酸奈米粒子可以迅速打開 Caco-2 細胞之間的緊密連接,增加 EGCG 的細胞外轉移,從而提高兒茶素的利用效率。殼聚醣/三聚磷酸鹽奈米顆粒顯著改善胃腸道吸收EGCG,從而提高 EGCG 的生物利用度。口服給藥後,暴露於血漿和空腸中的 EGCG 量分別增加了 1.5 倍和 2.3 倍。
奈米乳液
奈米乳液是由油相、水相、表面活性劑和助表面活性劑組成的透明或半透明分散體。粒徑通常在 5 到 200 nm 之間。作為載體,它可以提高不溶性營養素的溶解度、穩定性和生物利用度。由於其特殊的粒徑分佈和結構,它還具有緩釋和靶向作用。負載奈米乳的 EGCG 的緩慢釋放可歸因於 1-十二醇和大豆卵磷脂在模擬胃液條件下對 EGCG的保護作用。在茶多酚的藥物動力學研究中,負載奈米乳的茶多酚中EGCG的吸收比茶多酚溶液顯著提高了28.6%。結果表明,通過奈米乳系統遞送的茶多酚的緩慢釋放可以增強EGCG的吸收。與對照組相比,奈米乳化兒茶素的生物可及性比對照組高2.78倍,Caco-2細胞對兒茶素奈米乳化的表觀滲透係數(Papp)顯著高於非乳化兒茶素。
奈米脂質體
奈米脂質體是一種由磷脂和膽固醇組成的雙分子遞送系統。其結構和性質與細胞膜相似。奈米脂質體可將疏水性營養物質包裹在脂雙層中,親水性營養物質包裹在中間親水腔中,提高營養物質的穩定性,減少胃腸道酶和酸對營養物質的損害。由於脂質體的特殊脂質結構,脂質體很容易與腸黏膜細胞融合,吸收和交換脂質,使包裹的營養物質容易進入體內。奈米脂質體包封可顯著提高EGCG在模擬腸液中的穩定性. 1.5 h內EGCG的殘留量分別為31.2%和47.7%。而EGCG溶液中EGCG的殘留量分別為3.4%和3.5%。奈米脂質體包封可有效延緩EGCG體外抗氧化活性的降解。以磷脂酰膽鹼和膽固醇為載體製備EGCG奈米脂質體。結果表明EGCG奈米脂質體具有良好的胃腸道穩定性。不同濃度EGCG奈米脂質體在Caco-2細胞中的吸收呈劑量依賴性。
雙乳液
雙乳液也是一種較好的載體傳遞系統,一般可分為兩種:水包油滴(W/O/W)和油包油滴(W/O/W)和油包油滴(O/W/O)。雙乳液是熱力學不穩定的乳液。影響其穩定性的關鍵參數是乳液的組成、乳化條件和內部液滴的滲透壓。然而,與單一乳液相比,它們有幾個優點。例如,雙重乳液可以捕獲和保護各種物質(例如,激素、維生素、酚類化合物以及氨基酸),然後控制它們從一個階段釋放到另一個階段。因此,雙乳劑常用於微膠囊的封裝和遞送,例如藥物、營養素和化妝品。在食品行業,他們可以將營養和生物活性化合物結合起來,創造出高效的功能性產品。特別是在EGCG的保護研究中,雙乳劑具有良好的包封率。此外,已經表明雙乳液給藥系統可以增加 Caco-2 細胞對 EGCG 的吸收。大鼠藥物動力學研究表明,雙乳液給藥系統對EGCG的吸收是EGCG的1.93倍。同時,製備的EGCG膠囊可以保持6個月的穩定性。
通過奈米運送EGCG 遞送的問題
目前,越來越多的奈米給藥已被用於提高EGCG的利用率。可根據包裹材料的性質和用途選擇不同的奈米遞送載體。奈米遞送載體可以增強EGCG的腸道穩定性,延長腸道滯留時間,促進腸道吸收。殼聚醣奈米顆粒對腸黏膜具有良好的粘附性,延長了包埋材料與腸上皮的接觸時間。一些研究表明EGCG以被動擴散的形式進入腸細胞。在EGCG轉運過程中,EGCG可以通過外排相關蛋白泵出細胞。然而,負載奈米載體的EGCG可以通過改變EGCG進入細胞的方式來促進腸道吸收。然而,不同的奈米載體有不同的局限性。由於粒徑小、比表面積大的限制,生物活性的包封率低,會突然釋放。有研究表明,分子間相互作用形成的奈米顆粒在過量離子、胃腸道pH值和不同消化酶的影響下容易發生變化。因此,EGCG在輸送過程中不能很好地防止降解和氧化。另一個不容忽視的限制是奈米粒子的化學功能化,因為生物大分子的功能需要在共軛過程中和之後保留。例如,水性和緩衝介質、額外的表面保護、三維分子結構和取向應確保其奈米粒子中生物分子的功能化。其他研究表明,奈米顆粒可以與血液中的循環底物、蛋白質和其他分子相互作用,所有這些都可能限制其治療效果。
奈米乳液的穩定性還受溫度、鹽離子濃度和 pH 值的影響。為了增強口服奈米乳的穩定性,通常使用一些高濃度的表面活性劑和助表面活性劑。然而,目前對奈米乳劑的形成機制和表面活性劑的作用以及口服奈米乳劑的負面影響的研究尚不清楚。
奈米脂質體的形成機制是磷脂與水分子之間的范德華力和親水-疏水相互作用。由於奈米脂質體是易於聚集和/或融合的動態結構,因此奈米級製備的脂質體最終可能成為微脂質體。此外,為了防止奈米脂質體的聚集、融合和沈澱,可以使用陽離子或陰離子磷脂在囊泡表面產生排斥性靜電荷。人們普遍認為,當zeta 電位高於 30 mV 且低於 -30 mV,脂質囊泡的隨機閾值為正且穩定。然而,在製備奈米脂質體時,添加的有機溶劑並不能保證其完全去除,這可能導致口服奈米脂質體的潛在毒性。
結論
目前已有許多關於提高口服EGCG生物利用度的研究報導。但仍存在一些問題:
(1)如何更有效地提高口服EGCG的腸道穩定性。
(2)如何影響腸道吸收口服EGCG的作用尚不清楚,有待進一步研究。
(3)模擬體外吸收模型,包括動物模型、外翻腸囊腫和Caco-2細胞模型,已被廣泛用於模擬體外吸收,但在人體胃腸道中存在更複雜的轉運機制。
體外試驗可能不能完全反映人體胃腸道的正常吸收情況。因此,EGCG在動物體內的吸收、分佈、代謝和排泄需要進一步研究。迄今為止,口服EGCG的結構修飾、奈米給藥系統等改善口服EGCG的相關技術還很有限,可能無法更有效地提高口服EGCG的生物利用度。需要再深入研究其藥物動力學和體內藥物動力學,以提高口服 EGCG 的生物利用度。
Bioavailability enhancement of EGCG by structural modification and nano-delivery: A review
參考文獻
Dai, W., Ruan, C., Zhang, Y., Wang, J., Han, J., Shao, Z., … & Liang, J. (2020). Bioavailability enhancement of EGCG by structural modification and nano-delivery: A review. Journal of Functional Foods, 65, 103732.